|
上海沙格企业管理咨询有限公司 
| 联系人:陈小姐 女士 (销售部) |
 |
| 电 话:021-68597208 |
 |
手 机:15001902415  |
 |
 |
|
 |
|
| 巴西ANVISA认证流程详解 |
随着国内制造商的海外市场不断拓展,巴西医疗器械市场准入的需求也不断上升。为适应广大客户的需求,开启了巴西市场准入服务。巴西市场对于医疗器械的准入有哪些要求,我们一起来看看吧。
01巴西医疗器械法规介绍
巴西医疗器械适用法规主要包括:适用于一般器械的Resolution RDC 751/2022和Resolution RDC 40/2015;适用于植入器械的Resolution RDC 185/2001;以及适用于体外诊断器械IVD的Resolution RDC 830/2023(于2024年6月1日正式生效)。
巴西法规对于医疗器械按照风险高低分为四类,其中一类风险*低,四类风险*高。分类规则,参考Resolution-RDC No.751, Attachment 1,和MDR分类规则基本一致。
基于产品风险等级的不同,巴西当局规定了不同的合规路径。其中I类和II类按照Cadastro路径,而III类和IV类按照Registro 路径执行。
但是不论是什么风险等级,境外制造商都应指定一名巴西授权代表作为持证人(BRH)来申请巴西当局ANVISA的相关证书。
02 巴西市场准入合规流程
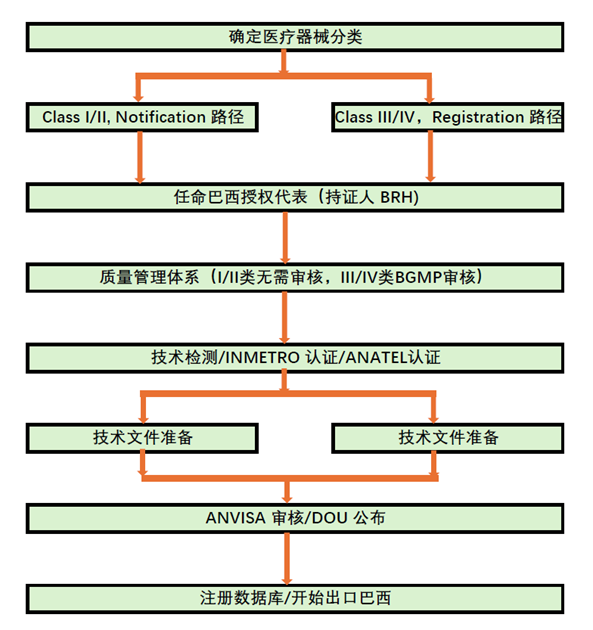
1. 基本流程
对于中国医疗器械产品希望出口巴西市场,基本流程如下:
确定医疗器械分类,并确定合规路径;
对于I/II类按照Notification备案路径,III/IV类按照Registration注册路径;
指定巴西授权代表,也是ANVISA注册证书的持证人;
建立质量管理体系以满足巴西GMP的要求,其中III/IV类需要通过ANVISA的审查;
完成产品检测,必要时完成INMETRO认证和ANATEL认证;
提交技术文件;
ANVISA评审审批;
产品出口巴西市场。
我们提供的服务项目
针对巴西医疗器械市场准入,我们可以提供的服务包括:
巴西授权代表;
巴西注册文件编写;
巴西注册提交以及和ANVISA的联络;
INMETRO认证和ANATEL认证的联络安排;
BGMP审核辅导/MDSAP辅导/陪同审核;
协助企业获得进口许可证。 |
|
|